TEORI KINETIK GAS
Gas Ideal
Gas dianggap
terdiri atas molekul-molekul gas yang disebut partikel. Teori ini tidak
mengutamakan kelakuan sebuah partikel tetapi meninjau sifat zat secara
keseluruhan sebagai hasil rata-rata kelakuan partikel tersebut. Untuk menyederhanakan permasalahan teori kinetik
gas diambil pengertian tentang gas ideal, dalam hal ini gas dianggap
sebagai gas ideal.
Sifat-sifat Gas Ideal
Sifat-sifat gas ideal adalah sebagai berikut.- Terdiri atas partikel yang banyak sekali dan bergerak sembarang.
- Setiappartikel mempunyai masa yang sama.
- Tidak ada gaya tarik menarik antara partikel satu dengan partikel lain.
- Jarak antara partikel jauh lebih besar disbanding ukuran sebuah partikel.
- Jika partikel menumbuk dinding atau partikel lain, tumbukan dianggap lenting sempurna.
- Hukum Newton tentang gerak berlaku.
- Gas selalu memenuhi hukum Boyle-Gay Lussac
Jumlah Atom tiap cm3
Pada keadaan standart 1 mol gas menempati volume sebesar 22.400 cm3 sedangkan jumlah atom dalam 1 mol sama dengan : 6,02 x 1023 yang disebut bilangan avogadro (No) Jadi pada keadaan standart jumlah atom dalam tiap-tiap cm3 adalah :Rumus Mol
Banyaknya mol untuk suatu gas tertentu adalah : hasil bagi antara jumlah atom dalam gas itu dengan bilangan Avogadro.
N = jumlah mol gas
N = jumlah atom
NA = bilangan avogadro 6,02 x 1023.
Demikian sedikit penjelasan tentang materi ini, jika mau membaca materi yang lainnya silahkan klik DISINI
Terima Kasih

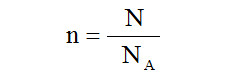
Tidak ada komentar:
Posting Komentar